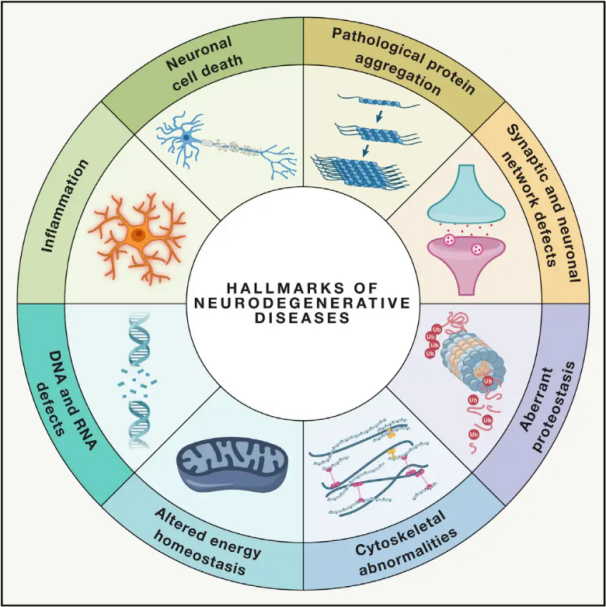
maladies neurodégénérativesLes maladies neurodégénératives (MND) sont caractérisées par la perte progressive ou persistante de populations neuronales vulnérables spécifiques au sein du cerveau ou de la moelle épinière. Leur classification peut reposer sur divers critères, notamment la distribution anatomique de la neurodégénérescence (comme les troubles extrapyramidaux, la dégénérescence fronto-temporale ou les ataxies spinocérébelleuses), les anomalies moléculaires primaires (comme les peptides β-amyloïdes, les prions, la protéine tau ou l'α-synucléine) ou les principales manifestations cliniques (comme la maladie de Parkinson, la sclérose latérale amyotrophique et la démence). Malgré ces différences de classification et de présentation clinique, des maladies comme la maladie de Parkinson, la sclérose latérale amyotrophique et la maladie d'Alzheimer partagent des mécanismes sous-jacents communs qui conduisent à un dysfonctionnement neuronal et, à terme, à la mort cellulaire.
Avec des millions de personnes touchées dans le monde par les maladies neurodégénératives, l'Organisation mondiale de la Santé estime que d'ici 2040, ces maladies deviendront la deuxième cause de mortalité dans les pays développés. Bien que divers traitements existent pour soulager et gérer les symptômes associés à des maladies spécifiques, les méthodes efficaces pour ralentir ou guérir leur progression restent difficiles à mettre au point. Des études récentes indiquent un changement de paradigme thérapeutique, passant d'une simple gestion symptomatique à l'utilisation de mécanismes de protection cellulaire pour prévenir toute aggravation. De nombreuses données suggèrent que le stress oxydatif et l'inflammation jouent un rôle crucial dans la neurodégénérescence, faisant de ces mécanismes des cibles essentielles pour la protection cellulaire. Ces dernières années, la recherche fondamentale et clinique a révélé le potentiel de l'oxygénothérapie hyperbare (OHB) dans le traitement des maladies neurodégénératives.
Comprendre l'oxygénothérapie hyperbare (OHB)
L'oxygénothérapie hyperbare (OHB) consiste généralement à augmenter la pression à plus d'une atmosphère absolue (ATA) – la pression au niveau de la mer – pendant 90 à 120 minutes, nécessitant souvent plusieurs séances selon l'affection traitée. Cette pression accrue améliore l'oxygénation des cellules, ce qui stimule la prolifération des cellules souches et favorise les processus de cicatrisation via certains facteurs de croissance.
À l'origine, l'application de l'oxygénothérapie hyperbare (OHB) reposait sur la loi de Boyle-Marriott, qui postule la réduction des bulles de gaz sous l'effet de la pression, ainsi que les bienfaits d'une forte oxygénation des tissus. De nombreuses pathologies bénéficient de l'état hyperoxique induit par l'OHB, notamment les tissus nécrosés, les lésions radio-induites, les traumatismes, les brûlures, le syndrome des loges et la gangrène gazeuse, comme le recense la Société de médecine sous-marine et hyperbare. L'OHB a également démontré son efficacité en tant que traitement adjuvant dans divers modèles de maladies inflammatoires ou infectieuses, telles que la colite et la septicémie. Grâce à ses mécanismes anti-inflammatoires et antioxydants, l'OHB offre un potentiel thérapeutique important pour les maladies neurodégénératives.
Études précliniques de l'oxygénothérapie hyperbare dans les maladies neurodégénératives : enseignements tirés du modèle murin 3×Tg
L'une des études notablesCette étude, menée sur un modèle murin 3×Tg de la maladie d'Alzheimer (MA), a mis en évidence le potentiel thérapeutique de l'oxygénothérapie hyperbare (OHB) pour atténuer les déficits cognitifs. Elle a comparé des souris mâles 3×Tg âgées de 17 mois à des souris mâles C57BL/6 âgées de 14 mois, utilisées comme témoins. Les résultats ont démontré que l'OHB améliorait non seulement les fonctions cognitives, mais réduisait également significativement l'inflammation, la charge amyloïde et la phosphorylation de la protéine Tau, un processus crucial associé à la pathologie de la MA.
Les effets protecteurs de l'oxygénothérapie hyperbare (OHB) ont été attribués à une diminution de la neuroinflammation. Ceci a été mis en évidence par la réduction de la prolifération microgliale, de l'astrogliose et de la sécrétion de cytokines pro-inflammatoires. Ces résultats soulignent le double rôle de l'OHB : elle améliore les performances cognitives tout en atténuant les processus neuro-inflammatoires associés à la maladie d'Alzheimer.
Un autre modèle préclinique a utilisé des souris traitées au 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP) pour évaluer les mécanismes protecteurs de l'oxygénothérapie hyperbare (OHB) sur la fonction neuronale et les capacités motrices. Les résultats ont indiqué que l'OHB contribuait à une amélioration de l'activité motrice et de la force de préhension chez ces souris, en corrélation avec une augmentation de la signalisation de la biogenèse mitochondriale, notamment par l'activation de SIRT-1, PGC-1α et TFAM. Ceci souligne le rôle important de la fonction mitochondriale dans les effets neuroprotecteurs de l'OHB.
Les mécanismes de l'oxygénothérapie hyperbare dans les maladies neurodégénératives
Le principe fondamental de l'oxygénothérapie hyperbare (OHB) pour les maladies neurodégénératives repose sur le lien entre la réduction de l'apport en oxygène et la susceptibilité aux changements neurodégénératifs. Le facteur inductible par l'hypoxie 1 (HIF-1) joue un rôle central en tant que facteur de transcription permettant l'adaptation cellulaire à une faible tension en oxygène et est impliqué dans diverses maladies neurodégénératives, notamment la maladie d'Alzheimer, la maladie de Parkinson, la maladie de Huntington et la sclérose latérale amyotrophique (SLA), ce qui en fait une cible thérapeutique cruciale.
L'âge étant un facteur de risque important pour de nombreux troubles neurodégénératifs, il est essentiel d'étudier l'impact de l'oxygénothérapie hyperbare sur la neurobiologie du vieillissement. Des études ont montré que l'oxygénothérapie hyperbare peut améliorer les déficits cognitifs liés à l'âge chez les sujets âgés en bonne santé.De plus, les patients âgés présentant des troubles importants de la mémoire ont montré des améliorations cognitives et une augmentation du débit sanguin cérébral après exposition à l'oxygénothérapie hyperbare.
1. Impact de l'oxygénothérapie hyperbare sur l'inflammation et le stress oxydatif
L'oxygénothérapie hyperbare (OHB) a démontré sa capacité à atténuer la neuroinflammation chez les patients atteints de dysfonctionnement cérébral sévère. Elle possède la capacité de diminuer la production de cytokines pro-inflammatoires (telles que l'IL-1β, l'IL-12, le TNFα et l'IFNγ) tout en augmentant celle de cytokines anti-inflammatoires (comme l'IL-10). Certains chercheurs suggèrent que les espèces réactives de l'oxygène (ERO) générées par l'OHB sont à l'origine de plusieurs effets bénéfiques de cette thérapie. Par conséquent, outre son action de réduction des bulles d'air dépendante de la pression et l'obtention d'une saturation tissulaire élevée en oxygène, les résultats positifs associés à l'OHB dépendent en partie des rôles physiologiques des ERO produites.
2. Effets de l'oxygénothérapie hyperbare sur l'apoptose et la neuroprotection
Des recherches ont montré que l'oxygénothérapie hyperbare (OHB) peut réduire la phosphorylation de la protéine kinase activée par les mitogènes p38 (MAPK) dans l'hippocampe, améliorant ainsi les fonctions cognitives et atténuant les lésions hippocampiques. L'OHB, seule ou en association avec un extrait de Ginkgo biloba, diminue l'expression de Bax et l'activité des caspases-9/3, ce qui réduit l'apoptose chez les rongeurs exposés au peptide β25-35. De plus, une autre étude a démontré que le préconditionnement par OHB induit une tolérance à l'ischémie cérébrale, via une augmentation de l'expression de SIRT1, une élévation des taux de Bcl-2 et une réduction de la caspase-3 active, soulignant ainsi les propriétés neuroprotectrices et anti-apoptotiques de l'OHB.
3. Influence de l'oxygénothérapie hyperbare sur la circulation etNeurogenèse
L'exposition des sujets à l'oxygénothérapie hyperbare (OHB) a été associée à de multiples effets sur le système vasculaire crânien, notamment l'augmentation de la perméabilité de la barrière hémato-encéphalique, la stimulation de l'angiogenèse et la réduction de l'œdème. Outre l'augmentation de l'apport d'oxygène aux tissus, l'OHBfavorise la formation vasculaireen activant des facteurs de transcription comme le facteur de croissance endothélial vasculaire et en stimulant la prolifération des cellules souches neurales.
4. Effets épigénétiques de l'oxygénothérapie hyperbare
Des études ont révélé que l'exposition des cellules endothéliales microvasculaires humaines (HMEC-1) à l'oxygène hyperbare régule de manière significative 8 101 gènes, y compris des expressions à la hausse et à la baisse, mettant en évidence une augmentation de l'expression des gènes associés aux voies de réponse antioxydante.
Conclusion
L'utilisation de l'oxygénothérapie hyperbare (OHB) a considérablement progressé au fil du temps, démontrant sa disponibilité, sa fiabilité et son innocuité en pratique clinique. Bien que l'OHB ait été explorée comme traitement hors indication pour les maladies neurodégénératives et que certaines recherches aient été menées, il demeure urgent de réaliser des études rigoureuses afin de standardiser les pratiques d'OHB dans le traitement de ces affections. Des recherches supplémentaires sont essentielles pour déterminer les fréquences de traitement optimales et évaluer l'ampleur des effets bénéfiques pour les patients.
En résumé, l'intersection entre l'oxygénothérapie hyperbare et les maladies neurodégénératives représente une frontière prometteuse en matière de possibilités thérapeutiques, justifiant une exploration et une validation continues en milieu clinique.
Date de publication : 16 mai 2025

