Dans le domaine de la médecine moderne, les antibiotiques constituent l'une des avancées les plus importantes, ayant permis de réduire considérablement l'incidence et la mortalité liées aux infections microbiennes. Leur capacité à modifier l'évolution clinique des infections bactériennes a prolongé l'espérance de vie d'innombrables patients. Les antibiotiques sont essentiels dans les interventions médicales complexes, telles que les chirurgies, la pose d'implants, les transplantations et la chimiothérapie. Cependant, l'émergence de pathogènes résistants aux antibiotiques est une préoccupation croissante, car elle diminue l'efficacité de ces médicaments au fil du temps. Des cas de résistance aux antibiotiques ont été documentés pour toutes les catégories d'antibiotiques, en raison des mutations microbiennes. La pression de sélection exercée par les médicaments antimicrobiens a contribué à l'augmentation des souches résistantes, ce qui représente un défi majeur pour la santé mondiale.
Pour lutter contre le problème urgent de la résistance aux antimicrobiens, il est essentiel de mettre en œuvre des politiques efficaces de contrôle des infections afin de limiter la propagation des agents pathogènes résistants, tout en réduisant l'utilisation des antibiotiques. Par ailleurs, le besoin de méthodes de traitement alternatives est criant. L'oxygénothérapie hyperbare (OHB) apparaît comme une modalité prometteuse dans ce contexte ; elle consiste à inhaler de l'oxygène pur à des niveaux de pression spécifiques pendant une durée déterminée. Utilisée comme traitement principal ou complémentaire des infections, l'OHB pourrait offrir un nouvel espoir dans le traitement des infections aiguës causées par des agents pathogènes résistants aux antibiotiques.
Cette thérapie est de plus en plus utilisée comme traitement principal ou alternatif pour diverses affections, notamment l'inflammation, l'intoxication au monoxyde de carbone, les plaies chroniques, les maladies ischémiques et les infections. Les applications cliniques de l'oxygénothérapie hyperbare dans le traitement des infections sont remarquables et offrent des avantages inestimables aux patients.

Applications cliniques de l'oxygénothérapie hyperbare dans le traitement des infections
Les données actuelles confirment l'efficacité de l'oxygénothérapie hyperbare (OHB), en monothérapie ou en traitement adjuvant, et ses bénéfices significatifs pour les patients infectés. Lors d'une OHB, la pression partielle d'oxygène dans le sang artériel peut atteindre 2 000 mmHg, et le gradient de pression tissulaire élevé qui en résulte peut élever la pression partielle d'oxygène dans les tissus jusqu'à 500 mmHg. Ces effets sont particulièrement bénéfiques pour favoriser la guérison des réactions inflammatoires et des troubles microcirculatoires observés en contexte ischémique, ainsi que pour la prise en charge du syndrome des loges.
L'oxygénothérapie hyperbare (OHB) peut également avoir un impact sur les affections dépendantes du système immunitaire. Des recherches indiquent que l'OHB peut supprimer les syndromes auto-immuns et les réponses immunitaires induites par les antigènes, contribuant ainsi au maintien de la tolérance à la greffe en réduisant la circulation des lymphocytes et des leucocytes tout en modulant les réponses immunitaires. De plus, l'OHBfavorise la guérisonDans les lésions cutanées chroniques, ce traitement stimule l'angiogenèse, un processus essentiel à une meilleure cicatrisation. Il favorise également la formation de la matrice de collagène, une étape fondamentale de la cicatrisation.
Une attention particulière doit être portée à certaines infections, notamment les infections profondes et difficiles à traiter telles que la fasciite nécrosante, l'ostéomyélite, les infections chroniques des tissus mous et l'endocardite infectieuse. L'une des applications cliniques les plus fréquentes de l'oxygénothérapie hyperbare concerne les infections cutanées et des tissus mous ainsi que l'ostéomyélite associées à une hypoxie, souvent causées par des bactéries anaérobies ou résistantes.
1. Infections du pied diabétique
Pied diabétiqueLes ulcères constituent une complication fréquente chez les patients diabétiques, touchant jusqu'à 25 % de cette population. Les infections de ces ulcères sont fréquentes (40 à 80 % des cas) et entraînent une augmentation de la morbidité et de la mortalité. Les infections du pied diabétique (IPD) sont généralement des infections polymicrobiennes impliquant diverses bactéries anaérobies pathogènes. Différents facteurs, tels que des anomalies de la fonction des fibroblastes, des problèmes de formation du collagène, des dysfonctionnements des mécanismes immunitaires cellulaires et de la fonction phagocytaire, peuvent entraver la cicatrisation chez les patients diabétiques. Plusieurs études ont identifié une oxygénation cutanée altérée comme un facteur de risque majeur d'amputations liées aux IPD.
L'une des options actuelles pour le traitement de l'infection du pied diabétiqueL’oxygénothérapie hyperbare (OHB) améliore significativement la cicatrisation des ulcères du pied diabétique, réduisant ainsi le recours aux amputations et aux interventions chirurgicales complexes. Elle minimise non seulement la nécessité de procédures invasives, telles que les lambeaux et les greffes de peau, mais présente également des coûts moindres et des effets secondaires minimes comparée aux options chirurgicales. Une étude de Chen et al. a démontré que plus de 10 séances d’OHB entraînaient une amélioration de 78,3 % du taux de cicatrisation chez les patients diabétiques.
2. Infections nécrosantes des tissus mous
Les infections nécrosantes des tissus mous (INM) sont souvent polymicrobiennes, généralement dues à une combinaison de bactéries pathogènes aérobies et anaérobies, et sont fréquemment associées à une production de gaz. Bien que relativement rares, les INM présentent un taux de mortalité élevé en raison de leur progression rapide. Un diagnostic et un traitement précoces et appropriés sont essentiels pour obtenir des résultats favorables, et l'oxygénothérapie hyperbare (OHB) a été recommandée comme méthode adjuvante dans la prise en charge des INM. Cependant, l'utilisation de l'OHB dans les INM reste controversée en raison du manque d'études prospectives contrôlées.Des données suggèrent qu'il pourrait y avoir une corrélation avec une amélioration des taux de survie et une meilleure préservation des organes chez les patients atteints de NSTI.Une étude rétrospective a indiqué une réduction significative des taux de mortalité chez les patients atteints d'infections nécrosantes des tissus mous recevant une oxygénothérapie hyperbare.
1.3 Infections du site opératoire
Les infections du site opératoire (ISO) peuvent être classées selon la localisation anatomique de l'infection et peuvent être causées par divers agents pathogènes, notamment des bactéries aérobies et anaérobies. Malgré les progrès réalisés en matière de prévention des infections, tels que les techniques de stérilisation, l'utilisation d'antibiotiques prophylactiques et l'amélioration des pratiques chirurgicales, les ISO demeurent une complication persistante.
Une importante étude a examiné l'efficacité de l'oxygénothérapie hyperbare (OHB) dans la prévention des infections profondes du site opératoire (ISO) lors de la chirurgie de la scoliose neuromusculaire. L'OHB préopératoire pourrait réduire significativement l'incidence des ISO et favoriser la cicatrisation. Ce traitement non invasif crée un environnement où les niveaux d'oxygène dans les tissus de la plaie sont élevés, ce qui est associé à une action oxydante éliminant les agents pathogènes. De plus, il corrige la baisse des niveaux sanguins et d'oxygène qui contribuent au développement des ISO. Au-delà des autres stratégies de contrôle des infections, l'OHB est particulièrement recommandée pour les interventions chirurgicales propres-contaminées, telles que les interventions colorectales.
1,4 brûlures
Les brûlures sont des lésions causées par une chaleur extrême, un courant électrique, des produits chimiques ou des radiations et peuvent entraîner des taux de morbidité et de mortalité élevés. L'oxygénothérapie hyperbare (OHB) est bénéfique dans le traitement des brûlures en augmentant le taux d'oxygène dans les tissus endommagés. Cependant, les études animales et cliniques présentent des résultats mitigés concernantl'efficacité de l'oxygénothérapie hyperbare dans le traitement des brûluresUne étude menée auprès de 125 patients brûlés a indiqué que l'oxygénothérapie hyperbare (OHB) n'avait pas d'impact significatif sur la mortalité ni sur le nombre d'interventions chirurgicales, mais réduisait le temps de cicatrisation moyen (19,7 jours contre 43,8 jours). L'intégration de l'OHB à une prise en charge globale des brûlures pourrait permettre de contrôler efficacement la septicémie chez ces patients, entraînant une cicatrisation plus rapide et une diminution des besoins en fluides. Toutefois, des recherches prospectives plus approfondies sont nécessaires pour confirmer le rôle de l'OHB dans la prise en charge des brûlures étendues.
1.5 Ostéomyélite
L'ostéomyélite est une infection de l'os ou de la moelle osseuse, souvent causée par des bactéries pathogènes. Son traitement peut s'avérer complexe en raison de la faible vascularisation des os et de la pénétration limitée des antibiotiques dans la moelle osseuse. L'ostéomyélite chronique se caractérise par la persistance des agents pathogènes, une inflammation modérée et la formation de tissu osseux nécrosé. On parle d'ostéomyélite réfractaire lorsque l'infection osseuse chronique persiste ou récidive malgré un traitement approprié.
L'oxygénothérapie hyperbare (OHB) a démontré améliorer significativement l'oxygénation des tissus osseux infectés. De nombreuses études de cas et de cohortes indiquent que l'OHB améliore les résultats cliniques chez les patients atteints d'ostéomyélite. Son action semble reposer sur divers mécanismes, notamment la stimulation de l'activité métabolique, la suppression des agents pathogènes bactériens, l'amélioration de l'efficacité des antibiotiques, la réduction de l'inflammation et la promotion de la cicatrisation.Après une oxygénothérapie hyperbare, 60 % à 85 % des patients atteints d'ostéomyélite chronique réfractaire présentent des signes de suppression de l'infection.
1.6 Infections fongiques
À l'échelle mondiale, plus de trois millions de personnes souffrent d'infections fongiques chroniques ou invasives, entraînant plus de 600 000 décès par an. L'efficacité des traitements est souvent compromise par des facteurs tels que l'altération du système immunitaire, les maladies sous-jacentes et la virulence des agents pathogènes. L'oxygénothérapie hyperbare (OHB) représente une option thérapeutique prometteuse pour les infections fongiques sévères, grâce à son innocuité et son caractère non invasif. Des études indiquent que l'OHB pourrait être efficace contre des agents pathogènes fongiques comme Aspergillus et Mycobacterium tuberculosis.
L'oxygénothérapie hyperbare (OHB) favorise les effets antifongiques en inhibant la formation de biofilm d'Aspergillus, avec une efficacité accrue observée chez les souches dépourvues de gènes de superoxyde dismutase (SOD). Les conditions hypoxiques observées lors des infections fongiques compliquent l'administration des antifongiques ; l'augmentation du taux d'oxygène induite par l'OHB représente donc une intervention potentiellement bénéfique, bien que des recherches supplémentaires soient nécessaires.
Propriétés antimicrobiennes de l'oxygénothérapie hyperbare
L'environnement hyperoxique créé par l'oxygénothérapie hyperbare (OHB) induit des modifications physiologiques et biochimiques qui stimulent les propriétés antibactériennes, faisant de l'OHB un traitement adjuvant efficace contre les infections. L'OHB présente des effets remarquables contre les bactéries aérobies et, surtout, contre les bactéries anaérobies, grâce à des mécanismes tels que l'activité bactéricide directe, le renforcement des réponses immunitaires et des effets synergiques avec des agents antimicrobiens spécifiques.
2.1 Effets antibactériens directs de l'oxygénothérapie hyperbare
L'effet antibactérien direct de l'HBOT est largement attribué à la génération d'espèces réactives de l'oxygène (ROS), qui comprennent des anions superoxyde, du peroxyde d'hydrogène, des radicaux hydroxyles et des ions hydroxyles, tous produits lors du métabolisme cellulaire.
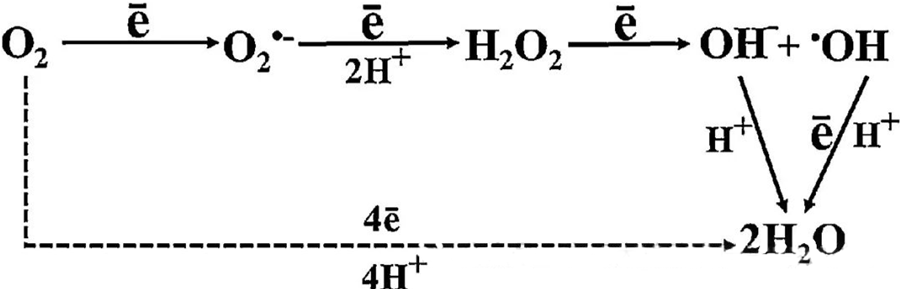
L'interaction entre l'O₂ et les composants cellulaires est essentielle pour comprendre la formation des ROS au sein des cellules. Dans certaines conditions, appelées stress oxydatif, l'équilibre entre la formation et la dégradation des ROS est perturbé, entraînant une augmentation de leur concentration intracellulaire. La production de superoxyde (O₂⁻) est catalysée par la superoxyde dismutase, qui convertit ensuite O₂⁻ en peroxyde d'hydrogène (H₂O₂). Cette conversion est amplifiée par la réaction de Fenton, qui oxyde le Fe²⁺ pour générer des radicaux hydroxyles (·OH) et du Fe³⁺, initiant ainsi une cascade de réactions d'oxydoréduction délétères conduisant à la formation de ROS et à des dommages cellulaires.
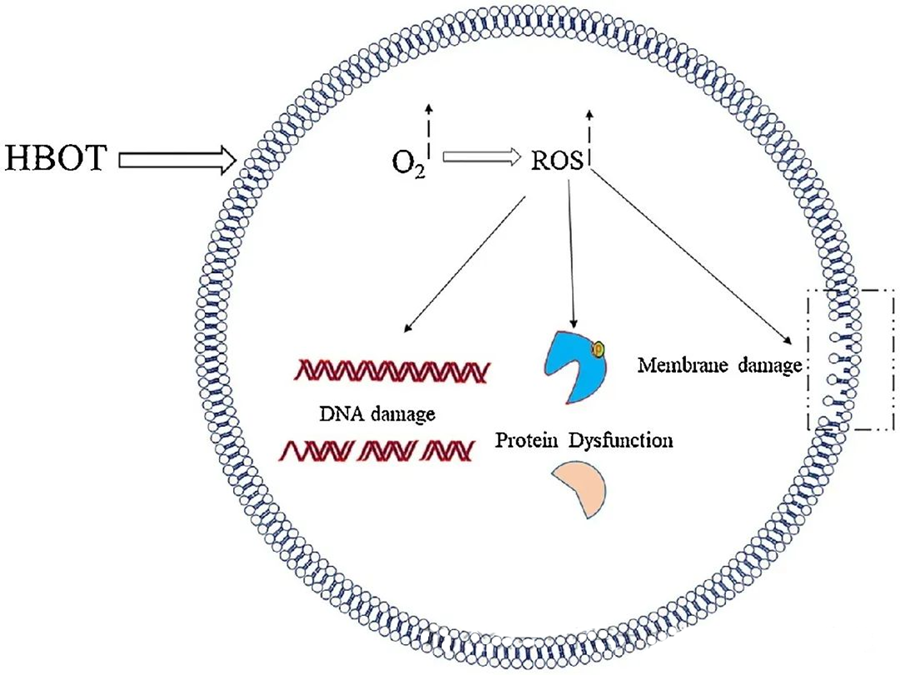
Les effets toxiques des ROS ciblent des composants cellulaires essentiels tels que l'ADN, l'ARN, les protéines et les lipides. L'ADN est notamment une cible privilégiée de la cytotoxicité induite par le peroxyde d'hydrogène (H₂O₂), car ce dernier perturbe les structures désoxyribose et endommage la composition en bases. Les dommages physiques induits par les ROS affectent la structure en hélice de l'ADN, potentiellement en raison de la peroxydation lipidique déclenchée par ces mêmes ROS. Ceci souligne les conséquences néfastes d'une concentration élevée de ROS au sein des systèmes biologiques.
Action antimicrobienne des ROS
Les espèces réactives de l'oxygène (ROS) jouent un rôle essentiel dans l'inhibition de la croissance microbienne, comme le démontre la production de ROS induite par l'oxygénothérapie hyperbare (HBOT). Les effets toxiques des ROS ciblent directement les constituants cellulaires tels que l'ADN, les protéines et les lipides. De fortes concentrations d'espèces réactives de l'oxygène peuvent endommager directement les lipides, entraînant une peroxydation lipidique. Ce processus compromet l'intégrité des membranes cellulaires et, par conséquent, la fonctionnalité des récepteurs et des protéines membranaires.
De plus, les protéines, qui constituent également des cibles moléculaires importantes des ROS, subissent des modifications oxydatives spécifiques au niveau de divers résidus d'acides aminés tels que la cystéine, la méthionine, la tyrosine, la phénylalanine et le tryptophane. Par exemple, il a été démontré que l'oxygénothérapie hyperbare induit des modifications oxydatives dans plusieurs protéines d'E. coli, notamment le facteur d'élongation G et DnaK, affectant ainsi leurs fonctions cellulaires.
Renforcement de l'immunité par l'oxygénothérapie hyperbare
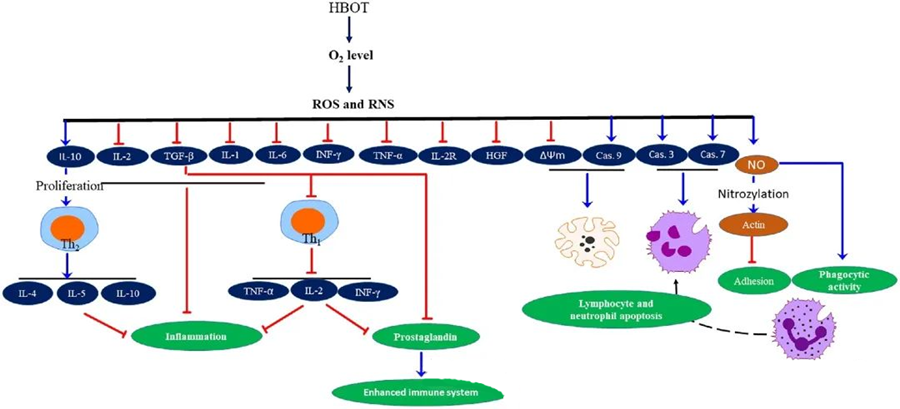
Les propriétés anti-inflammatoires de l'oxygénothérapie hyperbareDes études ont démontré l'importance de l'oxygénothérapie hyperbare (OHB) pour atténuer les lésions tissulaires et freiner la progression de l'infection. L'OHB influence significativement l'expression des cytokines et d'autres régulateurs de l'inflammation, modulant ainsi la réponse immunitaire. Différents modèles expérimentaux ont mis en évidence des modifications de l'expression génique et de la production de protéines après OHB, avec une régulation positive ou négative des facteurs de croissance et des cytokines.
Au cours de l'oxygénothérapie hyperbare, l'augmentation du taux d'oxygène induit diverses réponses cellulaires, notamment la suppression de la libération de médiateurs pro-inflammatoires et la promotion de l'apoptose des lymphocytes et des neutrophiles. L'ensemble de ces actions renforce les mécanismes antimicrobiens du système immunitaire, favorisant ainsi la guérison des infections.
De plus, des études suggèrent que l'augmentation des concentrations d'O₂ pendant l'oxygénothérapie hyperbare peut réduire l'expression des cytokines pro-inflammatoires, notamment l'interféron gamma (IFN-γ), l'interleukine-1 (IL-1) et l'interleukine-6 (IL-6). Ces modifications incluent également une diminution du rapport CD4/CD8 des lymphocytes T et une modulation d'autres récepteurs solubles, entraînant finalement une augmentation des concentrations d'interleukine-10 (IL-10), essentielle pour lutter contre l'inflammation et favoriser la cicatrisation.
Les activités antimicrobiennes de l'oxygénothérapie hyperbare (OHB) sont étroitement liées à des mécanismes biologiques complexes. Il a été démontré que le superoxyde et l'hypertension induisent, de manière inconstante, l'activité antibactérienne et l'apoptose des neutrophiles induites par l'OHB. Après une OHB, l'augmentation marquée du taux d'oxygène renforce les capacités bactéricides des neutrophiles, un élément essentiel de la réponse immunitaire. De plus, l'OHB inhibe l'adhésion des neutrophiles, un processus médié par l'interaction des intégrines β présentes à leur surface avec les molécules d'adhésion intercellulaire (ICAM) des cellules endothéliales. L'OHB inhibe l'activité de l'intégrine β-2 des neutrophiles (Mac-1, CD11b/CD18) par un mécanisme dépendant de l'oxyde nitrique (NO), favorisant ainsi la migration des neutrophiles vers le site de l'infection.
Le réarrangement précis du cytosquelette est nécessaire à la phagocytose efficace des pathogènes par les neutrophiles. Il a été démontré que la S-nitrosylation de l'actine stimule sa polymérisation, facilitant potentiellement l'activité phagocytaire des neutrophiles après un prétraitement par oxygénothérapie hyperbare (OHB). De plus, l'OHB induit l'apoptose des lignées de lymphocytes T humains par la voie mitochondriale, et une mort lymphocytaire accélérée a été observée après OHB. Le blocage de la caspase-9, sans incidence sur la caspase-8, a mis en évidence les effets immunomodulateurs de l'OHB.
Les effets synergiques de l'oxygénothérapie hyperbare et des agents antimicrobiens
En pratique clinique, l'oxygénothérapie hyperbare (OHB) est fréquemment utilisée en association avec des antibiotiques pour lutter efficacement contre les infections. L'état hyperoxique induit par l'OHB peut influencer l'efficacité de certains antibiotiques. Des études suggèrent que certains bactéricides, comme les β-lactamines, les fluoroquinolones et les aminosides, agissent non seulement par des mécanismes intrinsèques, mais dépendent aussi, en partie, du métabolisme aérobie des bactéries. Par conséquent, la présence d'oxygène et les caractéristiques métaboliques des agents pathogènes sont essentielles pour évaluer l'efficacité thérapeutique des antibiotiques.
Des études ont démontré que de faibles concentrations d'oxygène peuvent accroître la résistance de Pseudomonas aeruginosa à la pipéracilline/tazobactam et qu'un environnement pauvre en oxygène contribue également à l'augmentation de la résistance d'Enterobacter cloacae à l'azithromycine. Inversement, certaines conditions hypoxiques peuvent accroître la sensibilité bactérienne aux tétracyclines. L'oxygénothérapie hyperbare (OHB) constitue une méthode thérapeutique adjuvante efficace : en induisant le métabolisme aérobie et en réoxygénant les tissus infectés hypoxiques, elle augmente la sensibilité des agents pathogènes aux antibiotiques.
Dans des études précliniques, l'association d'oxygénothérapie hyperbare (OHB) – administrée deux fois par jour pendant 8 heures à 280 kPa – et de tobramycine (20 mg/kg/jour) a réduit significativement la charge bactérienne dans l'endocardite infectieuse à Staphylococcus aureus. Ceci démontre le potentiel de l'OHB comme traitement adjuvant. Des investigations complémentaires ont révélé que, sous une pression de 3 ATA à 37 °C pendant 5 heures, l'OHB potentialisait notablement les effets de l'imipénem contre Pseudomonas aeruginosa infectant les macrophages. De plus, l'association d'OHB et de céfazoline s'est avérée plus efficace que la céfazoline seule dans le traitement de l'ostéomyélite à Staphylococcus aureus chez des modèles animaux.
L'oxygénothérapie hyperbare (OHB) augmente significativement l'action bactéricide de la ciprofloxacine contre les biofilms de Pseudomonas aeruginosa, notamment après 90 minutes d'exposition. Cette potentialisation est attribuée à la formation d'espèces réactives de l'oxygène (ERO) endogènes et se traduit par une sensibilité accrue chez les mutants déficients en peroxydase.
Dans des modèles de pleurésie à Staphylococcus aureus résistant à la méthicilline (SARM), l'effet combiné de la vancomycine, de la teicoplanine et du linézolide avec l'oxygénothérapie hyperbare (OHB) a démontré une efficacité significativement accrue contre le SARM. Le métronidazole, un antibiotique largement utilisé dans le traitement des infections anaérobies et polymicrobiennes sévères telles que les infections du pied diabétique (IPD) et les infections du site opératoire (ISO), a montré une efficacité antimicrobienne supérieure en conditions anaérobies. Des études complémentaires sont nécessaires pour explorer les effets antibactériens synergiques de l'OHB combinée au métronidazole, in vivo et in vitro.
L'efficacité antimicrobienne de l'oxygénothérapie hyperbare sur les bactéries résistantes
Face à l'évolution et à la propagation des souches résistantes, les antibiotiques traditionnels perdent souvent de leur efficacité au fil du temps. De plus, l'oxygénothérapie hyperbare (OHB) peut s'avérer essentielle dans le traitement et la prévention des infections causées par des pathogènes multirésistants, constituant une stratégie cruciale lorsque les traitements antibiotiques échouent. De nombreuses études ont rapporté les effets bactéricides significatifs de l'OHB sur des bactéries résistantes cliniquement pertinentes. Par exemple, une séance d'OHB de 90 minutes à 2 ATM a considérablement réduit la croissance du SARM. Par ailleurs, dans des modèles de ratio, l'OHB a renforcé les effets antibactériens de divers antibiotiques contre les infections à SARM. Des rapports ont confirmé l'efficacité de l'OHB dans le traitement de l'ostéomyélite causée par Klebsiella pneumoniae productrice d'OXA-48, sans nécessiter d'antibiotiques adjuvants.
En résumé, l'oxygénothérapie hyperbare représente une approche multifactorielle de la lutte contre les infections, renforçant la réponse immunitaire et potentialisant l'efficacité des agents antimicrobiens existants. Grâce à des efforts de recherche et développement approfondis, elle offre la possibilité d'atténuer les effets de la résistance aux antibiotiques, et représente un espoir dans la lutte contre les infections bactériennes.
Date de publication : 28 février 2025

